Reacciones orgánicas
Las reacciones orgánicas son reacciones químicas de formación y transformación de los compuestos. La mayor parte de tales reacciones ocurre solamente con la participación de compuestos orgánicos. Sin embargo, se conocen algunas transformaciones en las que los compuestos orgánicos se forman tanto por la interacción entre compuestos orgánicos e inorgánicos como por la interacción de compuestos inorgánicos. Un ejemplo del último caso es la síntesis de los aminoácidos naturales a partir del dióxido de carbono, amoniaco y agua, que se lleva a cabo en condiciones de laboratorio por la acción de radiación, descargas eléctricas y otras fuentes de energía.
Generalidades
Las reacciones orgánicas ocurren por la vía mecánica de etapas consecutivas, aunque existen también las reacciones concertadas y simultáneas. Estos procesos se acompañan por la formación de diferentes intermediarios tales como:
- carbocationes (R+)
- carboaniones (R-)
- radicales libres (R·)
- catión-radicales (R+)
- anión-radicales (R-)
- carbenos (R1R2C:)
- Nitrenos (R-N:) y otras partículas no estables.
Tipos de reacciones
Las reacciones orgánicas pueden ser clasificadas como homolíticas o heterolíticas, basándose en el modo de ruptura de enlaces en las moléculas orgánicas. Las primeras consisten en la ruptura simétrica de un enlace de dos electrones y dos centros que produce radicales libres. Las segundas transformaciones consisten en una ruptura asimétrica del enlace antes mencionado, formando dos partículas cargadas con signos opuestos (catión y anión).
Características
- Se debe a los grupos funcionales.
– Por alta densidad electrónica (doble o triple
enlace)
– Por fracción de carga positiva en el átomo de
carbono (enlaces C–Cl, C=O, CN)
- Ruptura de enlaces de alta energía.
– homolítica (por la presencia de radicales libres)
– heterolítica (el par electrónico va a un átomo)
- Desplazamientos electrónicos
Las sustancias reaccionan entre sí de maneras muy diversas: el gran número de reacciones químicas que se producen justifica la necesidad de clasificarlas para su estudio.
Hay diferentes tipos de reacciones químicas y varias formas de clasificarlas según el criterio elegido. Los criterios que se siguen son generalmente cuatro: el energético, el cinético, la transformación que se produce y la partícula intercambiada.
Desplazamientos electrónicos.
Efecto inductivo:
“Desplazamiento parcial del par electrónico en enlace sencillo “” hacia el átomo más electronegativo provocando fracciones de carga”.
El hidrógeno se toma como referencia
(no provoca efecto inductivo)
–I : Grupos que retiran electrones.
Ejemplos: –NO2, – COOH, – X (halógeno), –OH.
+I : Grupos que aportan electrones.
Ejemplos: –CH3, –CH2–CH3, –C(CH3), –COO–, –O–.
Se transmite a lo largo de la cadena a enlaces adyacentes, aunque cada vez más débilmente.
Efecto mesómero o resonancia:
“Desplazamiento del par de electrones “” del doble enlace hacia uno de los átomos por la presencia de pares electrónicos cercanos”.
Se produce cuando hay enlace múltiples y la posibilidad de que los e– se deslocalicen (átomo electronegativo con posibilidad de tener parejas de e– sin compartir).
Ejemplo: CH2=CH–CH=CH2 <>
+CH2–CH=CH–CH2– <>–CH2–CH=CH–CH2+
-Puede escribirse: CH2—CH—CH—CH2
-Todos los enlaces son intermedios entre simples y dobles.
-A mayor número de formas resonantes mayor estabilidad
Tipos de Rupturas de enlaces
Dichas rupturas, por lo general, pueden ocurrir en dos formas: ruptura hemolítica, y ruptura heterolítica. Ruptura homolítica: Tiene lugar cuando un enlace de tipo covalente A:B se ve roto de manera que cada uno de los átomos se queda con un electrón del par del enlace.
Estabilidad.
Radicales libres:
terciario > secundario > primario > metilo
Carbocationes: Grupos +I lo estabilizan
– (CH3)3CCl (CH3)3C+ + Cl–
– (CH3)3C+ > (CH3)2CH+ > CH3CH2+ > CH3+
Carbaniones: Grupos –I lo estabilizan
– Son muy inestables y sólo son posibles si el átomo de “C” lleva unido grupos “–I” que le liberen de parte de esa carga negativa: – Cl3CH Cl3C:– + H
Tipos de reactivos.
Homolíticos: Radicales libres.
– Son especies químicas que tienen átomos con electrones desapareados.
– Se forman en la reacciones con ruptura homolítica.
Nucleófilos: Tienen uno o más pares de electrones libres (bases de Lewis).
– Atacan a partes de molécula con deficiencia de electrones.
Electrófilos: Tienen orbitales externos vacíos (ácidos de Lewis)
– Atacan a zonas con alta densidad electrónica (dobles o triples enlaces)
Reacciones de sustitución. Es aquella en la que un átomo o grupo atómico existente en una molécula orgánica es sustituido o desplazado por otro.
Sustitución Radicalia
Sustitución Electrófila: La sustitución electrófila aromática (SEAr) es una reacción perteneciente a la química orgánica, en el curso de la cual un átomo, normalmente hidrógeno, unido a un sistema aromático es sustituido por un grupo electrófilo. ... donde Ar es un grupo arilo y E un electrófilo.
-Un reactivo electrófilo ataca zonas de alta densidad electrónica(dobles enlaces del anillo bencénico)
Sustitución Nucleófila: En química, una sustitución nucleófila es un tipo de reacción de sustitución en la que un nucleófilo, "rico en electrones", reemplaza en una posición electrófila, "pobre en electrones", de una molécula a un átomo o grupo, denominados grupo saliente.
Un reactivo nucleófilo ataca a un carbocatión.
Reacciones de adición Es aquella en la que dos moléculas reaccionantes se combinan parea formar un producto conteniendo los átomos de ambas moléculas reactivas. Consisten en la adición de una molécula al enlace de otra.
Adición Electrófila: (a doble o triple enlace)Una adición nucleófila o nucleofílica es una reacción de adición donde en un compuesto químico un enlace π es eliminado mediante la adición de un nucleófilo, creándose dos nuevos enlaces covalentes (uno en cada extremo de lo que era el enlace múltiple).
– Suelen seguir un mecanismo unimolecular.
– Siguen la regla de Markownikoff: “La parte positiva del reactivo se adiciona al carbono más hidrogenado”.
Adición Nucleófila: En sustancias orgánicas con dobles enlaces fuertemente polarizados. Ej.– C=OEn química orgánica, una adición nucléofila o nucleofílica es una reacción de adición donde en un compuesto químico un enlace π es eliminado mediante la adición de un nucleófilo, creándose dos nuevos enlaces covalentes (uno en cada extremo de lo que era el enlace múltiple).
Adición Radicálica: Es poco frecuente.
– Se produce en presencia de peróxidos. (antiMarkownikoff)
Reacciones de Eliminación. Consiste en la perdida intramolecular de una molécula en el seno de otra con formación de un enlace , que pueden ser simultaneas, pero a menudo son consecutivas . Si las rupturas se localizan sobre átomos contiguos dan lugar a enlaces múltiples (Situación mas frecuente). Pueden producirse una ciclación si el ataque se produce sobre dos átomos no contiguos. Siguen la regla de Saytzeff: “En las reacciones de eliminación el hidrógeno sale del carbono adyacente al grupo funcional que tiene menos hidrógenos”
Mecanismo de la deshidrohalogenación de halogenuros de alquilo (medio básico).
1ª etapa: (lenta)
–Nota: Esta reacción compite con la de sustitución,si bien en este caso, por formarse un carbocatión menos estable (secundario) se favorece la eliminación.
–El Br– neutraliza al Na+ y el H+ saliente reacciona
con el OH– formando H2O.
Mecanismo de la deshidratación de alcoholes (medio ácido)
1ª etapa: (protonación)
2ª etapa: (formación de carbocatión). (lenta)
3ª etapa: (formación de alqueno) (Saytzeff)
REACCION REDOX
Una reacción redox (o de oxidación-reducción) es un tipo de reacción química en donde se transfieren electrones entre dos especies. Se dice que hay una transferencia de electrones cuando hay un cambio en el número de oxidación entre los reactivos y los productos. Las reacciones redox están en todas partes.
En orgánica existen también reacciones redox.
Es más complejo determinar el estado de oxidación del C, ya que en una misma cadena, cada átomo de C puede tener un estado de oxidación distinto.
Como consecuencia de ello, al calcular el estado de oxidación, en ocasiones salen números fraccionarios, que no son sino las medias aritméticas de los estados de oxidación de cada uno de los átomos de carbono.
Habitualmente, se sigue utilizando el concepto de oxidación cómo aumento en la proporción de oxígeno y reducción como disminución es la proporción de oxígeno.
Reacciones Redox comunes.
- Oxidación de alquenos
- Ozonolisis.
- Oxidación de alcoholes.
- Oxidación y reducción de aldehídos y
- cetonas.
- Combustión.
Ozonolisis.
Es una reacción específica del doble enlace, que consiste en la ruptura del mismo partiendo la cadena en dos y formando ácidos carboxílicos o cetonas:
Ejemplo:
En presencia de un ambiente reductor, es posible obtener aldehídos en vez de ácidos carboxílicos.
Oxidación de alcoholes.
Los alcoholes se oxidan por acción del KMnO4 o del K2Cr2O7 a aldehídos o cetonas dependiendo de si se trata de un alcohol primario o secundario, respectivamente.
Los alcoholes terciarios, en cambio, son bastante resistentes a la oxidación
Oxidación y reducción de aldehídos y cetonas.
Los aldehídos son sustancias muy frágiles y reductoras y se oxidan con facilidad a ácidos. Los aldehídos también pueden transformarse en alcoholes primarios e incluso en hidrocarburos en presencia de un ambiente reductor fuerte, dependiendo del catalizador empleado.
En cambio, las cetonas sufren reacciones de reducción similares a los aldehídos, pero se resisten a ser oxidadas.
Combustión
Constituyen un caso especial dentro de las reacciones redox. En ellas, el compuesto se quema para formar CO2 y H2O y liberándose gran cantidad de energía.
Otras reacciones orgánicas
- Esterificación/hidrólisis ácida.
- Saponificación (hidrólisis básica).
- Condensación.
Esterificación o Hidrólisis ácida
Se produce entre ácidos carboxílicos cuando reaccionan con alcoholes:
R–COOH + R’–OH R–CO–O–R’ + H2O
Se forman ésteres y se desprende una molécula de agua.
Se trata de una reacción reversible.
Otras reacciones.
Saponificación (hidrólisis básica):
– Es una reacción de las grasas (triésteres de la glicerina o propanotriol).
–Es una reacción irreversible.
- Bolívar, G. (2020b, julio 1). Electrófilo: reacciones, ejemplos, electrofilicidad. Lifeder. https://www.lifeder.com/electrofilo/
- REACTIVIDAD QUÍMICA Y REACCIONES ORGÁNICAS. (2017, 18 octubre). ppt video online descargar. https://slideplayer.es/slide/3465318/
- Químicas, T. D. R. (s. f.). Ruptura de enlaces. Tipos de Reacciones. Recuperado 23 de octubre de 2020, de https://reaccionesiiquimica.blogspot.com/2019/02/ruptura-de-enlaces.html
- J. (2019a, febrero 14). Ruptura de enlaces químicos. RUPTURA DE ENLACES. https://quimicaconjonny.blogspot.com/2019/02/ruptura-de-enlaces-quimicos.html
- Nucleófilos y electrófilos. (s. f.). NUCLEOFILOS Y ELECTROFILOS. Recuperado 23 de octubre de 2020, de http://www.qorganica.es/QOT/T0/nucleofilos_electrofilos_exported/index.html
- PPTCES037CB33-A16V1 Clase Reactividad en química orgánica II. (s. f.). Reactividad en química orgánica II. Recuperado 23 de octubre de 2020, de https://slideplayer.es/slide/11726911/
- Mtrod, V. T. L. E. (2019, 18 mayo). Tipos de reacciones orgánicas. LA QUÍMICA ORGÁNICA EN INFOGRAFÍAS. https://infografiasquimicaorganica.wordpress.com/2019/04/24/tipos-de-reacciones-organicas-2/
- reacciones_de_sustitucion_nucleofila_en_sintesis_organica1.pdf


















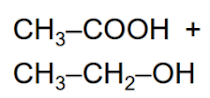

No hay comentarios:
Publicar un comentario