Grupo Carbonilo
• Es el grupo químico que se representa cuando un carbono tiene un doble enlace con un oxigeno.
Estructura
Tomando en cuenta esta estructura podemos encontrar los siguientes compuestos:


ALDEHIDO
Un ALDEHÍDO es un compuesto orgánico que contiene al menos un grupo carbonilo (-C=O) unido a una cadena carbonada (-R) pero siempre en posición terminal, es decir en un extremo de la cadena con lo que el grupo funcional se representa como -CHO.
Los aldehídos que contienen solo un grupo -CHO se nombran añadiendo la terminación -al al nombre del hidrocarburo correspondiente del que deriva. En este caso se debe elegir como cadena principal la más larga que lo contenga, de forma que se le asigne el localizador más bajo posible.Este grupo está formado por una molécula CHO, en donde el oxígeno está unido mediante un doble enlace al carbono.
•Al nombre de la cadena se le agrega la terminación al.
Ejemplos

Cuando el aldehído actúa como radical recibe el prefijo: FORMIL. 
CETONA
•Este grupo está formado por una átomo de carbono unido por un doble enlace a un átomo de oxígeno. Alrededor de esta molécula hay dos cadenas hidrocarbonadas.
•Existen dos formas de nombrar las cetonas.
NOMBRAMIENTO DE LAS CETONAS
PRIMERO
•Al nombre de la cadena se le agrega la terminación ona.
•Cuando sea necesario, se indica con un número la ubicación del grupo.
SEGUNDO
Se nombran por orden alfabético (como si fuesen sustituyentes) las dos cadenas que rodean al carbono que tiene un doble enlace con el oxígeno, y al final se coloca la palabra cetona.
Ejemplos
Se nombran utilizando el sufijo –ona, -diona, etc.

Las monocetonas pueden nombrarse también utilizando la nomenclatura por grupo funcional. Los grupos R y Rse consideran sustituyentes del carbonilo y por tanto se citan como prefijos en orden alfabético. Para terminar el nombre se añade la palabra cetona. Ej. Bencil etil cetona. Cuando cetonas o aldehidos no son el grupo principal se nombran con el prefijo “- oxo”
Aldehidos y cetonas (grupo carbóxilo, -OH)
Los aldehídos unidos directamente a un sistema cíclico se nombran añadiendo el sufijo –carbaldehído al nombre del ciclo. Ej: ciclohexanocarbaldehído. Si existen más de dos grupos carbonilo (fuera de la cadena), la cadena principal es la más larga que contenga el mayor número de grupos CHO. El nombre se construye añadiendo los sufijos –tricarbaldehído, etc. al nombre raiz que corresponde a la cadena principal (descontando los carbonos de los grupos carbonilo).
Ej:
Propiedades Físicas:
Las características especiales del grupo carbonilo influyen en las propiedades físicas de las cetonas y de los aldehídos.
Punto de ebullición: temperatura de ebullición mayor que hidrocarburos del mismo peso molecular, pero menor que el de los alcoholes y ácidos carboxílicos comparables. Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intramoleculares en éstos compuestos.
Los aldehídos y las cetonas no pueden formar enlaces intermoleculares de hidrógeno, porque al carecer de grupos hidroxilo (-OH) sus puntos de ebullición son más bajos que los alcoholes correspondientes. Sin embargo, los aldehídos y las cetonas pueden atraerse entre sí mediante las interacciones polar-polar de sus grupos carbonilo y sus puntos de ebullición son más altos que los de los alcanos correspondientes.
Con excepción del metanol, que es gaseoso a la temperatura ambiente, la mayor parte de los aldehídos y cetonas son líquidos y los términos superiores son sólidos. Los primeros términos de la serie de los aldehídos alifáticos tienen olor fuerte e irritante, pero los demás aldehídos y casi todas las cetonas presentan olor agradable por lo que se utilizan en perfumería y como agentes aromatizantes.
Solubilidad: a medida que aumenta el tamaño de las moléculas, disminuye la solubilidad de los compuestos. Los aldehídos y las cetonas pueden formar enlaces de hidrógeno con las moléculas polares del agua. Los primeros miembros de la serie (formaldehído, acetaldehído y acetona) son solubles en agua en todas las proporciones. A medida que aumenta la longitud de la cadena del hidrocarburo, la solubilidad en agua decrece. Cuando la cadena carbonada es superior a cinco o seis carbonos, la solubilidad de los aldehídos y de las cetonas es muy baja. Como era de suponer, todos los aldehídos y cetonas son solubles en solventes no polares.
Estado físico: bajo peso molecular (gases), peso molecular intermedio (líquidos) y compuesto pesados (sólidos).
Propiedades químicas
Las cetonas y los aldehídos se comportan como ácidos debido a la presencia del grupo carbonilo, esto hace que presenten reacciones típicas de adición nucleofílica.
- Reacciones de adición nucleofílica
- Reducción o hidrogenación catalítica
- Reacciones de sustitución halogenada
- Reacciones de condensación aldólica
- Reacciones de oxidación.
Se ha aislado una gran variedad de aldehídos y cetonas a partir de plantas y animales; muchos de ellos, en particular los de peso molecular elevado, tienen olores fragantes o penetrantes. Por lo general, se les conoce por sus nombres comunes, que indican su fuente de origen o cierta propiedad característica. A veces los aldehídos aromáticos sirven como agentes saborizantes. El benzaldehído (también llamado "aceite de almendra amargas") es un componente de la almendra; es un líquido incoloro con agradable olor a almendra. El cinamaldehído da el olor característico a la esencia de canela. La vainilla que produce el popular sabor a vainilla durante un tiempo se obtuvo solo a partir de las cápsulas con formas de vainas de ciertas orquídeas trepadoras. Hoy día, la mayor parte de la vainilla se produce sintéticamente:


Aldehídos:
El metanal (aldehído fórmico) es el aldehído con mayor uso en la industria, se utiliza fundamentalmente para la obtención de resinas fenólicas y en la elaboración de explosivos (pentaeritrol y el tetranitrato de pentaeritrol, TNPE) así como en la elaboración de resinas alquídicas y poliuretano expandido.
También se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos. Estos plásticos reciben el nombre de POM (polioximetileno)
Cetonas:
La cetona que mayor aplicación industrial tiene es la acetona (propanona) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción de polímeros (plexiglás, resinas epoxi y poliuretanos). Otras cetonas industriales son la metil etil cetona (MEK, siglas el inglés) y la ciclohexanona que además de utilizarse como disolvente se utiliza en gran medida para la obtención de la caprolactama, que es un monómero en la fabricación del Nylon 6 y también por oxidación del ácido adípico que se emplea para fabricar el Nylon 66.
Muchos aldehídos y cetonas forman parte de los aromas naturales de flores y frutas, por lo cual se emplean en la perfumería para la elaboración de aromas como es el caso del benzaldehído (olor de almendras amargas), el aldehído anísico (esencia de anís), la vainillina, el piperonal (esencia de sasafrás), el aldehído cinámico (esencia de canela).
De origen animal existe la muscona y la civetona que son utilizados como fijadores porque evitan la evaporación de los aromas además de potenciarlos por lo cual se utilizan en la industria de la perfumería.
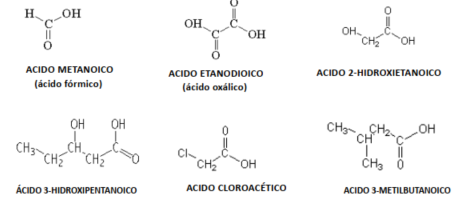
Ácidos Carboxílicos
EJEMPLO
![]()
Ácidos carboxílicos (R-COOH): Método sistematico: se nombran añadiendo los sufijos “–oico” ó “–dioico” al nombre raiz. (R).
Para compuestos con el grupo –COOH enlazado a un anillo se usa el sufijo “-
carboxílico”. El carbono al que está enlazado el carboxilo lleva el índice 1 y el carbono carbonílico no se numera en este sistema.
Ejemplos: Ácido 2-hidroxipropanotricarboxilico
Solubilidad:
El grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la molécula de agua. Esto hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos completamente solubles en agua. La solubilidad disminuye a medida que aumenta el número de átomos de carbono.
A partir del ácido dodecanóico o ácido láurico los ácidos carboxílicos son sólidos blandos insolubles en agua.
Punto de ebullición: Los ácidos carboxílicos presentan puntos de ebullición elevados debido a la presencia de doble puente de hidrógeno.
Punto de fusión: El punto de fusión varía según el número de carbonos, siendo más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después de 6 carbonos el punto de fusión se eleva de manera irregular.
Los ácidos carboxílicos son moléculas con geometría trigonal plana. Presentan hidrógeno ácido en el grupo hidroxilo y se comportan como bases sobre el oxígeno carbonílico. Los puntos de fusión y ebullición son elevados ya que forman dímeros, debido a los enlaces por puentes de hidrógeno
La propiedad más característica de los ácidos carboxílicos es la acidez del hidrógeno situado sobre el grupo hidroxilo. El pKa de este hidrógeno oscila entre 4 y 5 dependiendo de la longitud de la cadena carbonada. Los sustituyentes atrayentes de electrones aumentan la acidez de los ácidos carboxílicos. Grupos de elevada electronegatividad retiran carga por efecto inductivo del grupo carboxílico, produciendo un descenso en el pKa del hidrógeno ácido. El efecto inductivo aumenta con la electronegatividad del halógeno, con la proximidad del halógeno al grupo carboxílico y con el número de halógenos.
Ácidos Carboxílicos. Propiedades
Ésteres (R-COOR’):
- CH3-(C=O)-O-CH3 → etanoato de metilo
- CH3-(C=O)-O-CH2-CH3 → etanoato de etilo
- CH3-CH2-CH2-(C=O)-O-CH2-CH3 → butanoato de etilo
- CH3-CH2-(C=O)-O-CH3 → propanoato de metilo
Éster como sustituyente
Propiedades
- Pueden formar enlaces de hidrógeno
- Son más solubles que los hidrocarburos de los que derivan pero menos que los alcoholes correspondientes
- Tienen un olor característico que los hace ser empleados como fragancias artificiales
Hidrólisis de ésteres
Tioésteres
REFERENCIAS
Formulación
y nomenclatura en química orgánica: ALDEHÍDOS. (2020, 3 octubre). Recuperado 3
de octubre de 2020, de https://tuprofedequimica.blogspot.com/2015/09/formulacion-y-nomenclatura-en-quimica_27.html
Ejemplos de
Ésteres. (s. f.-b). Recuperado 3 de octubre de 2020, de https://www.quimicas.net/2015/05/ejemplos-de-esteres.html
Ejemplo de
Cetonas. (s. f.). Recuperado 3 de octubre de 2020, de https://www.ejemplode.com/38-quimica/4725-ejemplo_de_cetonas.html
Tioéster. (s. f.). Recuperado 3 de octubre de 2020, de https://esacademic.com/dic.nsf/eswiki/1153260
Abiogénesis: el enigma del origen (I). (2011, 7 mayo). Recuperado 3 de octubre de 2020, de https://rescepto.wordpress.com/2011/05/05/abiogenesis-el-enigma-del-origen-i/

















No hay comentarios:
Publicar un comentario