ALCOHOL
Los alcoholes son un grupo de moléculas orgánicas caracterizadas por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructural mente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
• Durante la destilación del petróleo se recuperan ciertas cantidades de
mezclas de alcoholes en el rango C3 hasta C5, que se utilizan
principalmente como materias primas para la producción de otros
compuestos.
• Cantidades importantes de glicerina, un alcohol con tres grupos
hidroxilo, se obtienen en la saponificación de las grasas naturales para
la producción de jabón. La glicerina se usa extensamente en la
preparación de cremas y productos cosméticos.
CARACTERÍSTICAS GENERALES
- En estado puro no tiene color.
- Es considerado una droga porque cambia la forma en que las personas perciben el mundo, sienten, y se comportan.
- Las bebidas alcohólicas contienen agua y etil alcohol y toman su color de acuerdo al ingrediente que se use para hacerlas.
- Los ingredientes utilizados con más frecuencia son frutas, vegetales o granos. También se pueden utilizar otras plantas.
PROPIEDADES
Con forme cambia a mayor tamaño la molécula aumenta también su punto de fusión y por ende baja su solubilidad en agua. De esta manera puede estar en algunos casos en estado solido a temperatura ambiente.
Los alcoholes que cuentan con anillos aromáticos poseen mayor densidad.
La polaridad de los grupos -OH permite a estas moléculas establecer enlaces puente de hidrógeno con moléculas compañeras, o con aniones.
NOMENCLATURA
En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol.
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
- Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -ol.
- La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
- Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador.
ALCOHOLES IMPORTANTES
CLASIFICACIÓN
- Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: se obtiene una cetona + agua.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Un alcohol primario
Estructura de un alcohol primario
Los alcoholes primarios derivados de alcanos lineales son los más representativos. Empero, en la realidad cualquier estructura, sea lineal o ramificada, puede clasificarse dentro de este tipo de alcoholes siempre y cuando el grupo OH esté enlazado a un CH2. Entonces, estructuralmente todos tienen en común la presencia del grupo –CH2OH, llamado metilol.Reacciones químicas
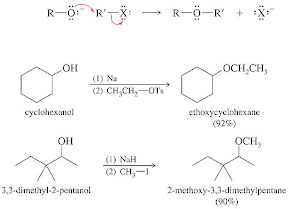
Formación de halogenuros de alquilo Los alcoholes reaccionan con los halogenuros de hidrógeno para producir halogenuros de alquilo. La reactividad de los alcoholes delante los halogenuros de hidrógeno, desciende en el orden siguiente: Alcohol terciario > alcohol secundario > alcohol primario ROH + HX => RX + H2O RX se trata de un halogenuro de alquilo primario (CH3Cl, CH3CH2Br, etc.).Oxidación de los alcoholes primarios
Los alcoholes pueden ser oxidados a aldehídos y a ácidos carboxílicos, dependiendo del reactivo. El clorocromato de piridinio (PCC) oxida al alcohol primario a aldehído, usando como solvente el diclorometano (CH2Cl2): CH3(CH2)5CH2OH => CH3(CH2)5COH Esta es la oxidación del 1-heptanol en 1-heptanal.Formación de éteres
Los alcoholes primarios pueden convertirse en éteres al ser calentado en presencia de un catalizador, generalmente ácido sulfúrico: 2 RCH2OH => RCH2OCH2R + H2OFormación de esteres orgánicos
La condensación de un alcohol y un ácido carboxílico, esterificación de Fisher, catalizada por un ácido, produce un ester y agua: R’OH + RCOOH <=> RCOOR’ + H2O Una reacción muy conocida es la del etanol con el ácido acético, para dar acetato de etilo: CH3CH2OH + CH3COOH <=> CH3COOHCH2CH3 + H2O El alcohol primario es el más susceptible a sufrir reacciones de esterificación de Fischer.Deshidratación
A temperaturas elevadas y en un medio ácido, generalmente de ácido sulfúrico, los alcoholes se deshidratan para originar alquenos con la pérdida de una molécula de agua. CH3CH2OH => H2C=CH2 + H2O Esta es la reacción de deshidratación del etanol a etileno. Una fórmula general más adecuada para este tipo de reacción, específicamente para un alcohol primario, sería: RCH2OH => R=CH2 (lo que también es igual a RC=CH2)Nomenclatura
Ejemplos
Un alcohol secundario
Estructura de un alcohol secundario
Las estructuras de los alcoholes dependen de la naturaleza de los grupos R. No obstante, para los alcoholes secundarios se puede hacer cierta amplificación, considerando que solo puede haber estructuras lineales con o sin ramificaciones, o estructuras cíclicas. Por ejemplo, se tiene la siguiente imagen:Propiedades
Acidez
Reacciones
Deshidratación
Reacción con metales activos
Esterificación
Nomenclatura
Ejemplos
2-Octanol Molécula de 2-octanol. Fuente: Jü [Public domain], from Wikimedia Commons Es un alcohol graso. Es un líquido incoloro, poco soluble en agua, pero soluble en la mayoría de los solventes no polares. Se utiliza, entre otros usos, en la elaboración de sabores y fragancias, pinturas y recubrimientos, tintas, adhesivos, cuidados del hogar y lubricantes.Un alcohol terciario
Estructura de un alcohol terciario
Tres alcoholes terciarios y sus estructuras. Fuente: Gabriel Bolívar. Considere las estructuras de los alcoholes terciarios superiores para aprender a reconocerlos sin importar cuál sea el compuesto. El carbono enlazado al OH debe también estar enlazado a otros tres carbonos. Si se observa detalladamente, los tres alcoholes cumplen con esto. El primer alcohol (en la izquierda), consiste de tres grupos CH3 enlazados al carbono central, cuya fórmula vendría a ser (CH3)3COH. El grupo alquilo (CH3)3C- se conoce como tertbutilo, está presente en muchos alcoholes terciarios y puede reconocerse fácilmente por su forma de T (la T roja de la imagen).Impedimento estérico
Propiedades
Acidez
Reactividad
Nomenclatura
Ejemplos
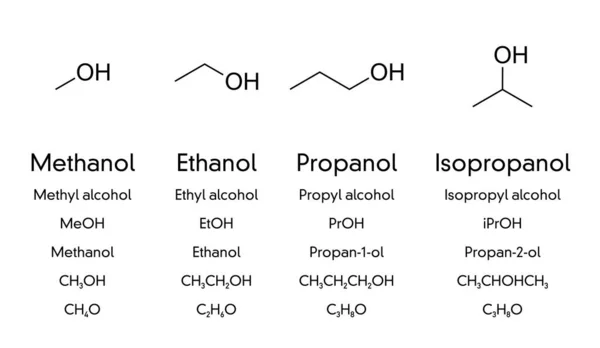
PROPIEDADES DE LOS ALCOHOLES:
• Estado físico (a 25 ºC)
• C1 a C4; son líquidos solubles totalmente en agua
• C5 a C12; líquidos aceitosos, no son tan solubles en agua.
• Los demás, son sólidos insolubles en agua.
• La insolubilidad disminuye con el aumento del peso molecular.
• Presentan entre sus moléculas enlace puente de hidrógeno, donde los polioles, poseen mayor número de enlaces puentes de hidrógenos
• Los polioles poseen mayor temperatura de ebullición que los monoles con igual número de carbonos.
• Son menos denso que el agua; los monoles que son inferiores, los polioles más densos
Según el número de hidroxilo:
• Monoalcohol o monol: Cuando presenta un hidroxilo
CH3 - CH2 – OH
• Dialcohol, diol o glicol: Cuando presenta dos hidroxilos
CH2 – CH2 OH OH
• Trialcohol o triol: Cuando presenta tres hidroxilo.
CH2 – CH – CH2 OH OH OH
• Polialcohol poliol: Cuando presenta cuatro o más hidroxilos.
Reglas de Nomenclatura
• Regla 1. Se elige como cadena principal la de mayor longitud
que contenga el grupo -OH.
• Regla 2. Se numera la cadena principal para que el grupo -OH
tome el localizador más bajo. El grupo hidroxilo tiene
preferencia sobre cadenas carbonadas, halógenos, dobles y
triples enlaces.
• Regla 3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
• Regla 4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a ser un sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
• Regla 5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
FENOLES
Nomenclatura de los fenoles
Radicales
PUNTOS DE FUSION
PUNTOS DE EBULLICIÓN
• Los Fenoles hierven a temperatura bastante elevadas gracias a los
puente de hidrógeno que su grupo funcional hidroxilo es capaz de
formar.
Fenol 182ºC
o-cresol 191ºC
m-cresol 201ºC
p-cresol 202ºC
o-clorofenol 175ºC
m-clorofenol 214ºC
p-clorofenol 217ºC
Catecol 246ºC
Resorcinol 281ºC
Hidroquinona 286ºC
SOLUBILIDAD
- Los fenoles son poco o moderadamente solubles en agua.
- Los isómeros o- pueden formar puentes de hidrógeno intramoleculares
- Si se introduce un segundo grupo OH se aumenta la solubilidad
Características Generales
- Son tóxicos si son ingeridos en altas dosis
- El fenol es utilizado como desinfectante al 5 % (se la llama agua fenificada)
- Son combustibles
- Son mucho más ácidos que los alcoholes porque el anillo aromático puede deslocalizar de manera efectiva la carga negativa del oxígeno dentro de los carbonos del anillo


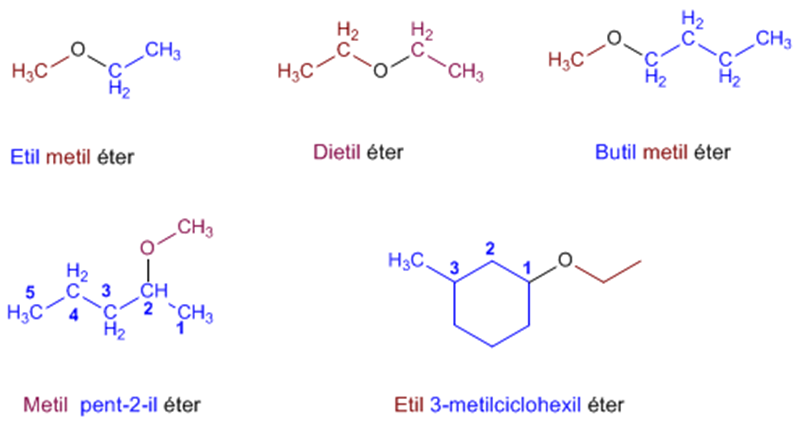
ETERES
Se caracterizan por poseer dos grupos carbonados ligados a un mismo átomo de oxígeno.
• Pueden ser:
• Dialquílicos R-O-R
• Diarílicos Ar-O-Ar
• Arilalquílicos Ar-O-R
• SIMÉTRICOS: Si los dos grupos carbonados ligados al oxígeno central son idénticos entre sí.
• ASIMÉTRICOS: Si ambos grupos son distintos.
• CÍCLICOS
• AROMÁTICOS
Nomenclatura

- O -, seguidos de la palabra ÉTER
En la nomenclatura UIQPA, se nombra el radical más sencillo (con la palabra OXI),
seguido sin guión del nombre del hidrocarburo del que deriva el radical más
complejo
CH 3 - CH2 - O - CH3
metoxietano
Propiedades
Propiedades Químicas
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .
Propiedades Físicas
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos. No puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles. Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclopropano.
Reacciones
Los éteres no son reactivos a excepción de los epóxidos.Las reacciones de los epóxidos pasan por la apertura del ciclo.Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
Tipos de éteres
Éteres corona: Hay éteres que contienen más de un grupo funcional éter (poliéteres) y algunos de éstos forman ciclos; estos poliéteres se denominan éteres corona. Pueden sintetizarse de distintos tamaños y se suelen emplear como ligandos, para acomplejar selectivamente (por el tamaño) a cationes alcalinos. Los oxígenos establecen interacciones con el catión, que se coloca en el centro del ciclo, formándose un complejo. Existen en la naturaleza compuestos de este tipo. Suelen servir como transporte de cationes alcalinos para que puedan atravesar las membranas celulares y de esta forma matener las concentraciones óptimas a ambos lados. Por esta razón se pueden emplear como antibióticos, como por ejemplo, la valinomicina. Otros compuestos relacionados son los criptatos, que contienen, además de átomos de oxígeno, átomos de nitrógeno. A los criptatos y a los éteres corona se les suele denominar ionóforos.
Poliéteres: Se pueden formar polímeros que contengan el grupo funcional éter. Un ejemplo de formación de estos polímeros: R-OH + n(CH2)O ! R-O-CH2-CH2-O-CH2-CH2-O-CH2-CH2-O-.. Los poliéteres más conocidos son las resinas epoxi, que se emplean principalmente como adhesivos. Se preparan a partir de un epóxido y de un dialcohol.
Epóxidos u oxiranos: Los epóxidos u oxiranos son éteres en donde el átomo de oxígeno es uno de los átomos de un ciclo de tres. Son pues compuestos heterocíclicos. Los ciclos de tres están muy tensionados, por lo que reaccionan fácilmente en reacciones de apertura, tanto con bases como con ácidos.
Éteres de silicio: Hay otros compuestos en los que el grupo funcional no es R-O-R', estando el oxígeno unido a dos carbonos, pero siguen siendo llamados éteres. Por ejemplo, los éteres de silicio, en donde la fórmula general es R-O-Si, es decir, el oxígeno está unido a un carbono y a un átomo de silicio. Sigue habiendo un par de electrones no enlazantes. Estos compuestos se llaman éteres de silicio.
Aplicación
Son múltiples las aplicaciones que tienen estos compuestos. La más utilizada es como disolventes de aceites y grasas. Otras de sus aplicaciones son: Anestésico general. Medio extractar para concentrar ácido acético y otros ácidos. Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos. Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides). Combustible inicial de motores Diesel.
EJEMPLOS
Tiol
En química orgánica, un tiol es un compuesto que contiene el grupo funcional formado por un átomo de azufre y un átomo de hidrógeno (-SH). Siendo el azufre análogo de un grupo alcohol (-OH), este grupo funcional es llamado grupo tiol o grupo sulfhidrilo. Tradicionalmente los tioles son denominados mercaptanos.
NOMENCLATURA
Cuando un grupo tiol es un sustituyente de un alcano, hay varias formas de nombrar al tiol resultante:
- El método preferido (utilizado por la IUPAC) consiste en añadir el sufijo -tiol al nombre del alcano. El método es casi idéntico a la denominación de alcoholes. Ejemplo: CH3SH sería metanotiol.
- Un viejo método, la palabra mercaptano sustituye alcohol en el nombre del compuesto equivalente de alcohol. Ejemplo: CH3SH sería metil mercaptán.
- Como prefijo, el término utilizado es mercapto. Ejemplo: mercaptopurina
Etimología
El término mercaptano viene del latín mercurius captans, que significa 'capturado por mercurio', debido a que el grupo –SH se une estrechamente al elemento mercurio.
Propiedades físicas
Olor
Muchos tioles son líquidos incoloros que tienen un olor parecido al del ajo. El olor de tioles es a menudo fuerte y repulsivo, en particular los de bajo peso molecular.
Puntos de ebullición y solubilidad
Debido a la pequeña diferencia de electronegatividad entre el azufre y el hidrógeno, un enlace S-H es prácticamente apolar covalente. Por lo tanto, el enlace S-H en los tioles tiene menor momento dipolar en comparación con el enlace O-H del alcohol.
Propiedades químicas
Síntesis
Los métodos utilizados para sintetizar tioles son análogos a los utilizados para la síntesis de alcoholes y éteres. Las reacciones son más rápidas y de mayor rendimiento porque los aniones de azufre son mejores nucleófilos que los átomos de oxígeno.
- Los tioles se forman cuando un haloalcano se calienta con una solución de hidrosulfuro de sodio CH3CH2Br + NaSH calentada en etanol (ac.) + → CH3CH2SH + NaBr
Además, los disulfuros pueden reducirse fácilmente por agentes reductores como el hidruro de litio aluminio en éter seco para formar dos tioles.
R-S-S-R' → R-SH + R'-SH
Reacciones
El grupo tiol es el análogo del azufre al grupo hidroxilo (-OH) que se encuentran en los alcoholes. Debido a que el azufre y el oxígeno pertenecen al mismo grupo de la tabla periódica, comparten algunas propiedades de enlace similares. Al igual que el alcohol, en general la forma desprotonada RS− (llamado tiolato) es químicamente más reactiva que la forma tiol protonada RSH.
Acidez
El átomo de azufre de un tiol es muy nucleofílico, bastante más que el átomo de oxígeno del alcohol. El grupo tiol es bastante ácido, con el pKa habitualmente alrededor de 10 a 11. En la presencia de una base se forma un anión tiolato, que es un muy potente nucleófilo. El grupo y su correspondiente anión son fácilmente oxidados por reactivos como el bromo para dar disulfuro orgánico (R-S-S-R).
2R-SH + Br2 → R-S-S-R + 2HBr
La oxidación por reactivos más poderosos como el hipoclorito de sodio o peróxido de hidrógeno resulta en ácidos sulfónicos (RSO3H).
2R-SH + 2H2O2 → RSO3H + 2H2O
Importancia biológica
Dado que es el grupo funcional del aminoácido cisteína, el grupo tiol desempeña un papel importante en los sistemas biológicos. Cuando los grupos tiol de dos residuos de cisteína (como en monómeros o unidades constituyentes) se acercan uno al otro durante el plegamiento de proteínas, una reacción de oxidación puede crear una unidad de cistina con un enlace disulfuro (-S-S-).
Tio esteres o sulfuros.
REFERENCIAS
- EcuRed. (s. f.-a). Alcohol - EcuRed. Recuperado de https://www.ecured.cu/Alcohol#:%7E:text=Concepto%3A,a%20un%20%C3%A1tomo%20de%20carbono.&text=Alcohol.&text=Su%20grupo%20funcional%20es%20el%20grupo%20hidroxilo%2C%20OH.
- G. (s. f.-a). clasificación de los alcoholes. Recuperado 12 de septiembre de 2020, de http://grupo-alcoholes.blogspot.com/2011/06/clasificacion-de-los-alcoholes.html#:%7E:text=Los%20alcoholes%20se%20clasifican%20en,se%20obtiene%20un%20%C3%A1cido%20carbox%C3%ADlico.
- Bolívar, G. (2019, 14 julio). Alcohol primario: estructura, propiedades, nomenclatura, ejemplos. Recuperado 12 de septiembre de 2020, de https://www.lifeder.com/alcohol-primario/
- Bolívar, G. (2019a, junio 8). Alcohol secundario: estructura, propiedades, nomenclatura, usos. Recuperado 12 de septiembre de 2020, de https://www.lifeder.com/alcohol-secundario/#:%7E:text=Un%20alcohol%20secundario%20tiene%20el,a%20tres%20%C3%A1tomos%20de%20carbonos.
- Bolívar, G. (2019c, julio 17). Alcohol terciario: estructura, propiedades, ejemplos. Recuperado 12 de septiembre de 2020, de https://www.lifeder.com/alcohol-terciario/#:%7E:text=Un%20alcohol%20terciario%20es%20aquel,X%20en%20la%20estructura%20molecular.&text=F%C3%B3rmula%20estructural%20de%20un%20alcohol%20terciario.
- EcuRed. (s. f.-b). Éter (química) - EcuRed. Recuperado 12 de septiembre de 2020, de https://www.ecured.cu/%C3%89ter_(qu%C3%ADmica)#:%7E:text=Concepto%3A,unido%20a%20dos%20radicales%20hidrocarbonados.
- Tiol. (s. f.). Recuperado 12 de septiembre de 2020, de https://www.quimica.es/enciclopedia/Tiol.html

No hay comentarios:
Publicar un comentario