¿Que es la química Orgánica?
La química orgánica es la disciplina científica que estudia la base, propiedades , estructura, síntesis y reacciones de los compuestos químicos formados por carbono e hidrógeno.
Se considera orgánico a los compuestos que contienen carbono , e inorgánicos a los compuestos que no tienen carbono. Sin embargo, existen compuestos que contienen carbono son inorgánicos , esto se debe a su bajo indice de carbono el cual se encuentra por debajo del 50%. A su vez existen compuestos orgánicos que contienen pequeñas cantidades de oxigeno, azufre, nitrógeno, halogenos, fósforo y silicio.
Aunque este bloc esta dirigido principalmente a la química orgánica, inevitablemente también estaremos hablando de algunos aspectos de la química inorgánica.
Para entender de que estamos hablando y a que nos referimos exactamente, en el siguiente cuadro comparativo se puede ver algunas diferencias entre química orgánica e inorgánica.
REFERENCIAS
- Enciclopedia de Ejemplos (2019). "Compuestos Orgánicos e Inorgánicos". Recuperado de: https://www.ejemplos.co/40-ejemplos-de-compuestos-organicos-e-inorganicos/
- Fuente: https://www.ejemplos.co/40-ejemplos-de-compuestos-organicos-e-inorganicos/#ixzz6RpU2OBrq
- YouTube. (2019, 10 diciembre). Recuperado 10 de julio de 2020, de https://www.youtube.com/watch?v=LlOv6SDxFAo&feature=youtu.be
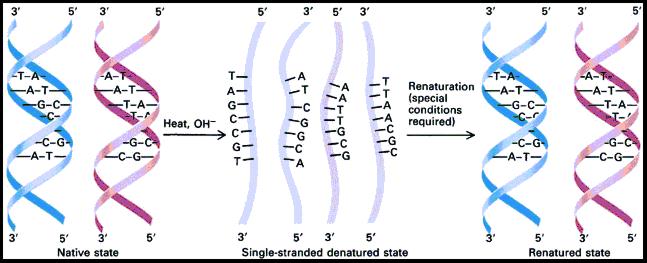
- Ramos, S. (s. f.). Hibridación de ADN y ARN: técnicas y equipos Tecnológicos de alta calidad y eficiencia. Recuperado 13 de julio de 2020, de http://blog.analitek.com/hibridacion-de-adn-y-arn-tecnicas-y-equpos-tecnologicos-de-alta-calidad-y-eficiencia-0-1
- Bolívar, G. (2020, 3 abril). Geometría molecular: concepto, tipos y ejemplos. Recuperado 13 de julio de 2020, de https://www.lifeder.com/geometria-molecular/
- Fórmulas y ecuaciones químicas - Monografias.com. (s. f.). Recuperado 15 de julio de 2020, de https://www.monografias.com/trabajos96/formulas-y-ecuaciones-quimicas/formulas-y-ecuaciones-quimicas.shtml#:%7E:text=Formula%20qu%C3%ADmica.,a%20una%20sustancia%20en%20particular.
- MargaritaValdiviaMedellin. (2016, 12 junio). Principios de la química y nutrición. Recuperado 16 de julio de 2020, de https://es.slideshare.net/MargaritaValdiviaMedellin/principios-de-la-qumica-y-nutricin
Espindola, A. (2012, 24 febrero). Carga formal. Recuperado 18 de julio de 2020, de https://es.slideshare.net/AntonioEspindola/carga-formal
U. (s. f.). Carga Formal. Recuperado 18 de julio de 2020, de http://johnheisenberg.blogspot.com/2012/06/cargaformal-la-carga-formal-de-un.html

Falto información sobre lo de Lewis, el ejemplo que colocas es jibiubio, cuidar que toda la información quede dentro del marco que estableciste en tu página
ResponderEliminarCorregido. Gracias.
ResponderEliminar