INTRODUCCIÓN A LOS ALCANOS.
Reciben su nombre del grupo Alquilo que esta compuesto por un carbono y tres hidrógenos, es claro que contienen otros grupos pero se le prefiere alquilo porque contienen consistentemente un grupo de este.
Los miembros mas pequeños de la familia de los alcanos son gases, mientras los mas grandes son líquidos y sólidos.
Características generales de los Hidrocarburos saturados o alcanos.
- La terminación <ANO>le permite saber que solo hay enlaces simples en estas moléculas.
- Se encuentran comúnmente de combustible, como el gas natural y el petroleo.
- Los compuestos sólidos son en su mayoría de textura cerosa.
- Pertenecen a una serie homologa de compuestos orgánicos en el que los miembros difieren por una masa molecular de 14 que es CH.
- Solo tienen enlaces simples, esto significa que están saturados de átomos de hidrógeno.
- Son Hidrocarburos básicos y el inicio para entender la química en otras moléculas.
- Están formados por carbono he hidrógeno
- Parafina, poca reactividad
- Hidrocarburos alifáticos saturados con carbonos.
- Representación Sp3
FORMULA GENERAL QUE REPRESENTA A LOS ALCANOS.
Esta formula nos permite calcular la formula molecular de un alcano. Ejemplo:
Alcanos lineales.
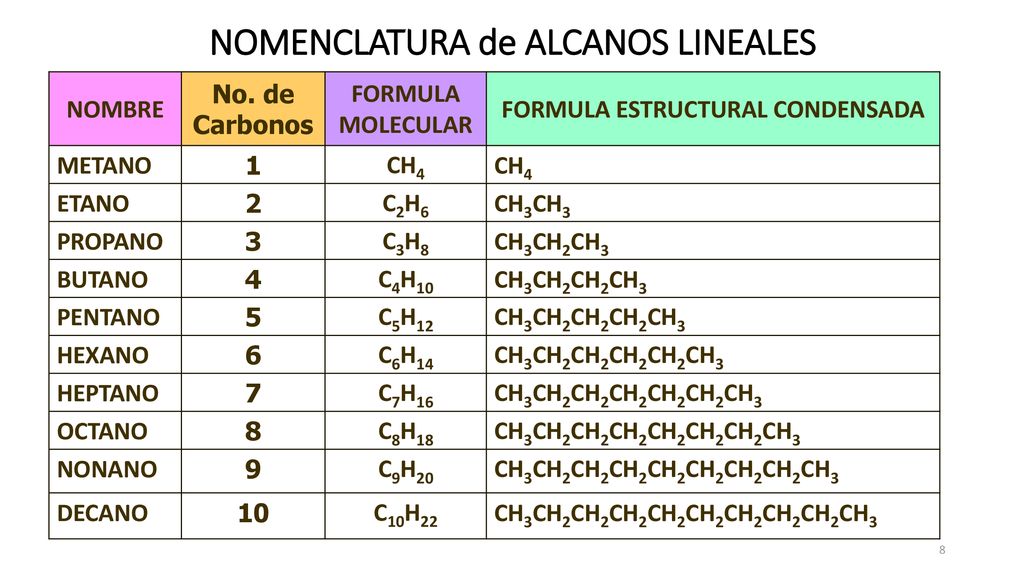
Formula estructural condensada
A diferencia de la formula estructural semidesarrollada o lineal que nos indica como están unidos los átomos, la formula estructural condensada nos dice solo su proporción.
Los Cicloalcanos
Los cicloalcanos (también llamados Aliciclicos o Alcanos Cíclicos) son compuestos orgánicos pertenecientes al grupo de los hidrocarburos, esto quiere decir que están formados solamente por átomos de carbono e hidrógeno.
La característica por la cual se diferencia del resto de los hidrocarburos es que sus átomos están unidos por enlaces simples en forma de anillo.
Formula general de los Cicloalcanos
La formula de los cicloalcanos es muy sencilla, en el caso del Ciclobutano que tiene 4 carbonos que se le atribuyen a los 4 lados del ciclo, es equivalente a 8 hidrógenos, ya que complementa la regla de los 4 enlaces. De igual manera el Ciclopentano 5 lados 5 carbonos, cada uno con 2 Hidrógenos nos da un total de 10 Hidrógenos. Lo mismo para los demás Cicloalcanos.
Representación Gráfica de los Cicloalcanos:
Los Cicloalcanos se suelen representar mediante polígonos sencillos. En cada vértice se entiende que existe un átomo de carbono con dos hidrógenos, en el siguiente vídeo se muestra la forma de cada uno de ellos representada de la siguiente manera:
1. Ciclohexano, Hexágono, 6 lados, 6 Carbonos, 12 Hidrógenos.
2. Ciclopropano, Triangulo, 3 lados, 3 carbonos, 6 Hidrógenos.
3. Ciclobutano, Cuadrado, 4 lados, 4 carbonos, 8 Hidrógenos.
4. Ciclopentano, Pentágono, 5 lados, 5 carbonos, 10 Hidrógenos.
Características generales de los cicloalcanos.
Se nombran como los alcanos de igual número de carbonos pero añadiendo el prefijo "Ciclo-":Ciclopropano, ciclobutano, ciclopentano, ciclohexano, cicloheptano etc.
Si poseen un radical se toma el nombre del ciclo como la cadena principal:
Ejemplo:
- Si poseen varios radicales ramificadas se toma el nombre del ciclo como la cadena principal:
- Se toma el nombre de la cadena que las forma
- Sus posiciones se señalan con números
- Se numeran en el sentido de las agujas del reloj o al revés de manera que resulte la combinación de números más bajos .
Propiedades de los Cicloalcanos:
- Su reactividad es equivalente a los alcanos
- Tienen Puntos de Fusión y Ebullición superiores a sus correspondientes Alcanos
- Su densidad es también mayor que la de su correspondiente Alcano.
- Son incoloros
- Son solubles en disolventes apolares, algunos ejemplos las grasas,aceites y ceras.
- Solo son estables el Ciclopentano y el Ciclohexano
- El gas de uso domestico es una mezcla de alcanos.
ISOMERIA
La isomería son compuestos distintos pero con la misma formula molecular, se dividen en isomería, la Isomería Estructural y la Estereoisomería.
Isomería Estructural
La Isomería Estructural esta dividida en Isomería de Función, Isomería de Cadena e Isomería de posición.
Isomería de Función:
Ocurre cuando dos o más compuestos tienen diferentes funciones químicas y la misma fórmula molecular.
Ejemplos:
Isomería de Cadena:
Poseen el mismo grupo funcional, pero la estructura de la cadena es diferente, pudiendo ser lineal, ramificada, etc., es decir, las uniones entre los C que forman la cadena son diferentes. Esto es posible a partir de cuatro átomos de carbono.
Ejemplos:
Isomería de posición:
La presentan los compuestos que tienen el mismo grupo funcional colocado en diferente posición dentro de la cadena carbonada. Sustancias que difieren únicamente en la situación de su grupo funcional.
Ejemplos:
La Estereoisomería
La Estereoisomería la presentan aquellas sustancias que, con la misma estructura, tienen diferente distribución espacial de sus átomos. Se divide en dos Isomeria Cis-Trans e Isomeria Optica.
Isomeria Cis-Trans
Es un tipo de estereoisomería de los alquenos y cicloalcanos. Se distingue entre el isómero cis, en el que los sustituyentes están en el mismo lado del doble enlace o en la misma cara del cicloalcano.
Importante: Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.
CIS TRANS


Isomeria Óptica
la presentan aquellos compuestos que se diferencian únicamente en su comportamiento frente a la luz polarizada. Se le denomina así precisamente por estar relacionada con una propiedad óptica.
Ejemplo: Hay dos isómeros ópticos; son imágenes especulares y no son superponibles.
Equilibrio Conformacional
Se puede transformar un confórmero en otro mediante la rotación en torno a enlaces simples, lo que no es posible en los esteroisómeros donde es necesario romper enlaces para transformar uno en otro.
En el siguiente vídeo podremos ver un ejemplo del etano en donde podremos visualizar la rotación del enlace carbono carbono de los tipos de conformaciones, alternada y eclipsada. También podremos apreciar las energías potenciales que se derivan de dichas conformaciones.
Análisis conformacional y proyección de Newman
La proyección de Newman se obtiene al mirar la molécula a lo largo del eje C-C. El carbono frontal se representa por un punto, del que parten los tres enlaces que lo unen a los sustituyentes. El carbono de atrás se representa por un círculo y los enlaces que salen de este carbono se dibujan a partir de este círculo.
A continuación, dibujaremos la proyección de Newman del etano alternado. Miramos la molécula situándonos en la posición de la flecha. Representamos el carbono que tenemos enfrente por un punto y sacamos los enlaces que parten hacia los hidrógenos. El carbono que está al fondo no podemos verlo, aunque si vemos los hidrógenos que parten de él (representados en rojo). Lo representamos por un círculo y sacamos los enlaces que lo unen a los hidrógenos (representados en azul).
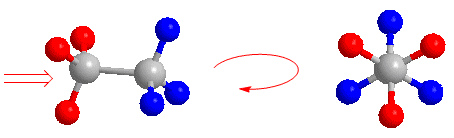
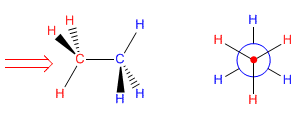
Ahora intentemos proyectar la conformación del etano que tiene todos los hidrógenos enfrentados (llamada conformación eclipsada). Situándonos en la posición de la flecha tenemos enfrente el carbono con los hidrógenos rojos. Los hidrógenos azules quedan tapados y no podemos verlos. En la proyección de Newman estos hidrógenos (azules) aparecen ligeramente girados para poder representarlos.
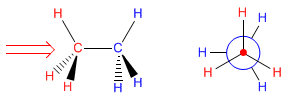
Análisis conformacional del etano
En este modelo utilizamos la representación de Newman y como vimos en el vídeo podemos notar que la conformación alternada es mas estable que la conformación eclipsada.
Diagrama de energía potencial del Etano
Este diagrama nos permite entender como cambia la energía potencial del sistema durante la rotación. En estos diagramas se representa la energía potencial de la molécula frente al ángulo girado.
En el etano esta barrera energética es pequeña, unas 2,9 Kcal/mol (12 KJ/mol), y permite que los confórmeros se interconviertan a elevada velocidad.
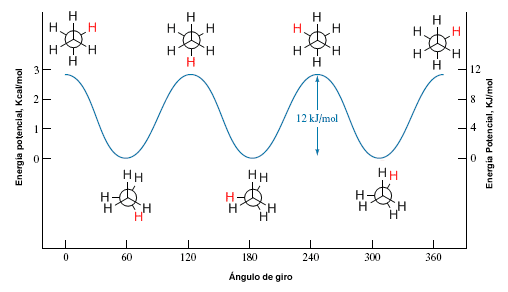
Puntos importantes
- Al girar un grupo metilo alrededor del eje C-C, empezando a partir de la conformación alternada,la distancia entre los hidrógenos disminuye, dando lugar a un aumento en la repulsión entre los pares enlazantes de los enlaces C-H.
- En el punto de eclipse, la molécula tiene su contenido máximo de energía.
- El cambio de energía asociado a la rotación alrededor del un enlace se llama energía rotacional o torsional.
- En este caso la superficie de energía potencial (SEP) es una función sinusoidal de periodo 120º y de amplitud 2.9 kcal/mol
Análisis conformacional del Propano
En este modelo utilizamos nuevamente la representación de Newman y podemos notar que la conformación alternada es mas estable que la conformación eclipsada.
Puntos Importantes
- En este caso también las formas extremas son las alternadas y la eclipsadas.
- La barrera en este caso es mayor que en el etano debido al impedimento estérico que
- en este caso involucra un metilo y un hidrógeno.
- La variación es sinusoidal porque tenemos el mismo efecto en cada giro
Tensión de anillo de un ciclobutano.
Es un tipo de inestabilidad que existe cuando los bonos en una molécula forman ángulos que son anormales. La tensión de anillo de un ciclobutano plano se debe a dos factores: la tensión angular debida a la compresión de los ángulos de enlace desde el ángulo tetraédrico de 109,5º hasta 90º, y la tensión torsional debida al eclipsamiento de los enlaces C-H.
Para distinguir las conformaciones espaciales es útil recurrir a la llamada proyección de Newman que intercala un disco imaginario entre los dos carbonos, de manera que las valencias próximas al espectador se ven enteras, mientras que las más alejadas sólo se ven en la parte que sobresale del disco.
La compresión para el batano es 19,5º. La tensión angular y la tensión torsional explican la alta reactividad de los anillos de cuatro átomos de carbono.
Conformaciones del ciclopropano.
Todos los enlaces carbono-carbono están eclipsados, generando una tensión torsional que contribuye a la tensión total del anillo. La tensión angular y la tensión torsional en el ciclopropano hacen que el tamaño de este anillo sea extremadamente reactivo.
Conformaciones del ciclopentano
La conformación del ciclopentano está ligeramente doblada, como la forma de un sobre. Esta conformación plegada reduce el eclipsamiento de los grupos CH2 adyacentes
Conformaciones del ciclohexano
Conformación de tipo silla.
Puntos importantes.
- El análisis conformacional del ciclohexano indica que las barreras del potencial son mayores y por lo tanto les podemos medir fácilmente en comparación con las otras familias
- El confórmero silla es el más estable.
- Las otras conformaciones bote y twist (bote retorcido) son menos estables
REFERENCIAS
- Diaz, R. (2019, 12 noviembre). Los 7 Usos y Aplicaciones de los Alcanos Principales. Recuperado 9 de agosto de 2020, de https://www.lifeder.com/usos-aplicaciones-alcanos/
- Propilo, B. (s. f.). HIDROCARBUROS SATURADOS (ALCANOS Y CICLOALCANOS). Recuperado 9 de agosto de 2020, de https://slideplayer.es/slide/13897183/
Visual, N. (2020, 9 junio). Tipos de isomería. 🥇 Concepto, ejemplos y ejercicios resueltos. Recuperado 21 de agosto de 2020, de https://nucleovisual.com/tipos-de-isomeria-plana-y-espacial/#:%7E:text=molecular%20de%20metilpropano-,Isomer%C3%ADa%20de%20funciones,com%C3%BAn%20entre%20aldeh%C3%ADdos%20y%20cetonas.
Isomería. (s. f.). Recuperado 21 de agosto de 2020, de http://www2.udec.cl/quimles/archivos/material-teorico/isomeria/isomeria.htm#:%7E:text=Isomer%C3%ADa%20de%20funci%C3%B3n.La%20presentan,funcional%20sustituido%20de%20formas%20distintas.
ESTEREOISOMERÍA | Isomería y Estereoisomería. (s. f.). Recuperado 21 de agosto de 2020, de https://isomeria2018.wixsite.com/misitio/estereoisomeria#:%7E:text=Los%20estereois%C3%B3meros%20no%20son%20is%C3%B3meros,sus%20%C3%A1tomos%20en%20el%20espacio.&text=Por%20ejemplo%2C%20los%20is%C3%B3meros%20cis,%C3%A1tomos%20en%20el%20mismo%20orden.
ISOMERÍA ÓPTICA. (s. f.). Recuperado 21 de agosto de 2020, de http://www.ehu.eus/biomoleculas/moleculas/optica.htm#:%7E:text=ISOMER%C3%8DA%20%C3%93PTICA&text=Existen%20mol%C3%A9culas%20que%20coinciden%20en,Son%20los%20llamados%20is%C3%B3meros%20%C3%B3pticos.
Equilibrio conformacional en el ciclohexano | Química Orgánica. (s. f.). Recuperado 21 de agosto de 2020, de http://www.quimicaorganica.net/ciclohexano-equilibrio-conformacional.html
Análisis conformacional del etano. (s. f.). Recuperado 21 de agosto de 2020, de https://es.khanacademy.org/science/organic-chemistry/bond-line-structures-alkanes-cycloalkanes/conformations-alkanes-cycloalkanes/v/conformational-analysis-of-ethane
Estructura y Estereoquímica de Alcanos. (s. f.). Recuperado 21 de agosto de 2020, de https://slideplayer.es/slide/3411636/
Fernández, G. (s. f.). Análisis conformacional de butano. Recuperado 21 de agosto de 2020, de https://www.quimicaorganica.org/alcanos/70-analisis-conformacional-de-butano.html
http://sgpwe.izt.uam.mx/pages/cbs/cuhp/QuimOrgII/M_1Hidroc.pdf
Buena ampliación de la información, solo debería de agregar ejercicios de nomenclatura
ResponderEliminarOk.
ResponderEliminar